1. Introduction of low pH incubation virus inactivation
In the production process of biological products,Virus removal and inactivation is a crucial process step,CDE《推荐全球十大博彩公司排行榜》及ICH Q5A《推荐全球最大网赌正规平台》中明确规定来源于动物细胞系的生物技术产品至少需要两种不同原理的病毒灭活/去除的步骤来保证产品无病毒污染。在抗体工艺流程设计中,典型的设计是在Protein A亲和层析后加上低pH孵育病毒灭活的工艺,低pH是最常用的病毒灭活方法,此方法相对简单、占地面积小并且通常不需要干预或者附加步骤即可灭活病毒。一个典型的病毒灭活操作包括酸化(VIA)和中和(VIN)步骤,亲和层析产物被调整到 pH 值3.6左右,并保持一段时间,以实现足够的病毒灭活,调节到接近中性的 pH 值(VIN),以便下一步处理。
2. Research significance
在IgG4单克隆抗体(mAb IgG4-N1)的低pH病毒灭活(VI)放大过程中,观察到大量可溶性产物聚集,而在相同条件下的小规模实验显示聚集可忽略不计。Uneven mixing and product exposure to low pH were identified as the root cause。为了解释该问题的机理,通过改变关键参数(包括pH、放置时间和蛋白质浓度)来研究蛋白质聚集特性。
此研究通过将IgG4-N1的分子性质和各种过程相关参数与宏观聚集现象联系起来,揭示了其在酸性条件下的主要聚集机制。这项研究还为下游VI操作中低pH诱导IgG4聚集的原因和缓解策略提供了有用的建议。

Use contains 66.5 L PAE(亲和层析洗脱收集液)且叶轮搅拌速度为50 rpm的SUM-100 Mixer进行IgG4-N1放大生产的VI。As shown in Table 1, the HMW aggregation levels of VIA and VIN samples were 1, respectively.7%和7.1%。VIN样品中的聚体量超过了IPT标准,并导致该批次生产失败。
Laboratory-scale tests were then carried out to simulate the scale-up conditions。在50 mL小烧杯中使用与放大操作相同的酸碱添加比例并使用磁力搅拌棒进行充分混合。如表1所示,实验室规模的VIA和VIN样品的HMW水平分别为1.3%和2.4%,远低于放大生产的HMW含量,因此VIN过程中显著的聚体形成与规模有关。由于放大规模中 SUM-100 Mixer使用顶部安装的叶轮,两个规模混合条件的差异可能会导致产品聚集差异。为了测试这一点,酸滴定过程进行搅拌与不搅拌对比实验,发现两组实验VIA和VIN样品的HMW水平分别从1.3% increased to 3.5%和2.4% increased to 13.0%。为了从机理上理解导致产物聚集的关键因素,我们进一步研究了IgG4-N1在相关溶液条件下的分子特性。
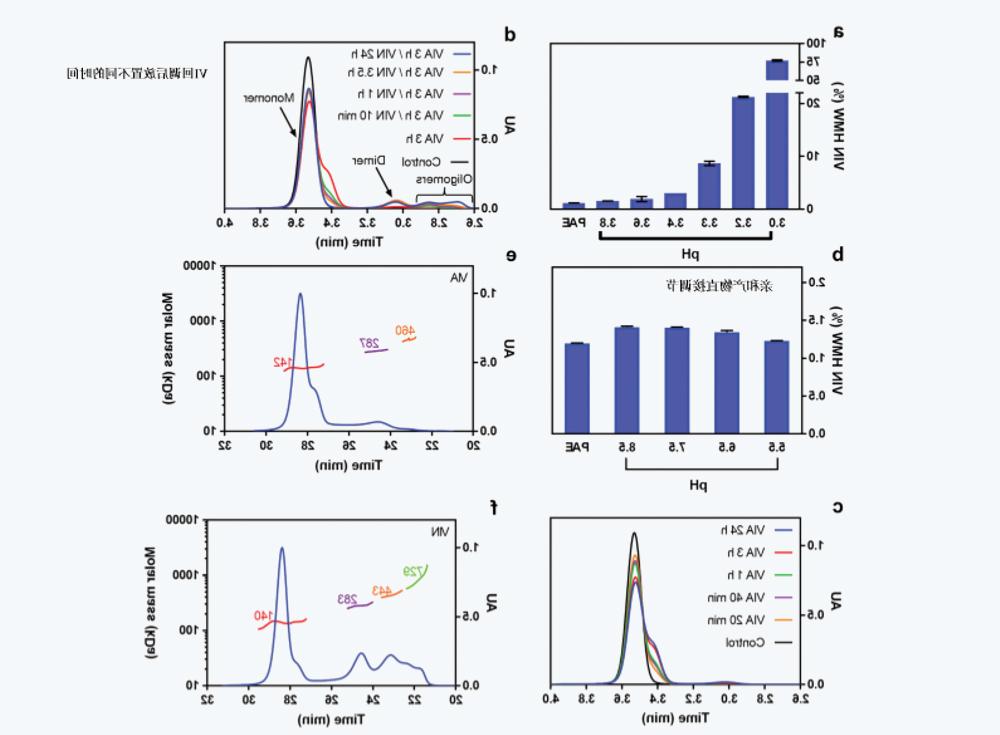

Effects of pH:
At pH 3.0-3.8之间研究了VIA的pH值对IgG4-N1聚集的影响,对pH值为5.5的VIN样品进行测试,以评估IgG4-N1暴露于各种VIA pH条件后的聚集行为。pH5.5 VIN样品的聚体水平通常在VIN pH值调节后约20小时达到稳定(如下所述),因此,在进行SEC测定前,将样品储存一夜。在较低的VIA pH值(图1a)下,VIN样品的HMW水平从1.6%(pH3.8) Nonlinearity increases to about 70% (pH 3.0), indicating that a lower pH value significantly leads to IgG4-N1 aggregation。
Effects of Hold time:
在评估HMW水平之前,将IgG4-N1 PAE样品调节至pH 3.3, leave at room temperature for different times (from 20 minutes to 24 hours)。如图1c所示,当直接测定VIA样品SEC而不进行pH回调时,SEC色谱图上观察到明显的前肩峰,并且肩峰的大小随VIA放置时间延长成比例增加。SEC-MALS数据(图1e,f)表明,对应于前肩峰组分与天然单体具有相同的分子量,因此可能是具有较大流体动力学半径的部分未折叠组分。为了研究VIN放置时间的影响,在SEC检测前,将放置3小时的VIA样品中和至pH 5.5, and leave at room temperature for different times (from 10 minutes to 24 hours)。In Figure 1d, at pH 3.3下观察到的前肩峰随着VIN放置时间增加而减少,并在24小时后最终消失,同时伴随着高分子量聚集物的增加。
Interaction of pH, Hold time, and protein concentration:
Using JMP®软件设计的全析因实验设计评估了通过pH、放置时间和IgG4-N1聚集的蛋白质浓度之间的相互作用。为了有助于此评估,通过使用单体衰减指数方程(方程1:)拟合动力学实验的单体分数来获得聚集速率常数(k值)。如图2a所示,由于蛋白质浓度对IgG4-N1聚集的影响在较低pH下更为明显,因此较低的蛋白质浓度产生较低的聚集电位。The curves in Figures 2b and 2c show a pH of 5, respectively.5 VIN的样品的相对聚集和单体含量,这些样品最初在30.A protein concentration of 0 g/L is subjected to a lower pH (3.0-3.6)。The contour plot in Figure 2d summarizes the data conforming to equation 1。结果表明,随着pH的降低,k以非线性方式增加(在pH约为3.The inflection point was observed at 3) and further increased with protein concentration。根据拟合曲线计算出的单体和高分子量值与此条件下的实验数据非常一致,因此,模型拟合的k值可用于比较不同VI条件,并提供了聚集倾向的定量评估,而无需对每个单独条件进行实验。例如,在图2e和2f中,“5分钟时HMW%”和“稳定期HMW%”的等高线图表明,由于产品聚集动力学强烈依赖于pH,VIA放置时间对VIN样品中的HMW水平有显著影响。
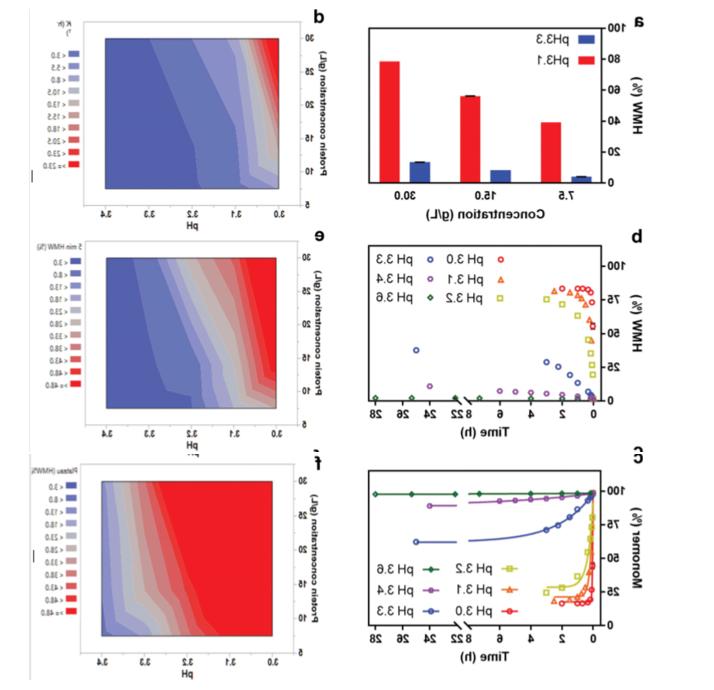


Table 2 Tm values of IgG4-N1 under different pH conditions
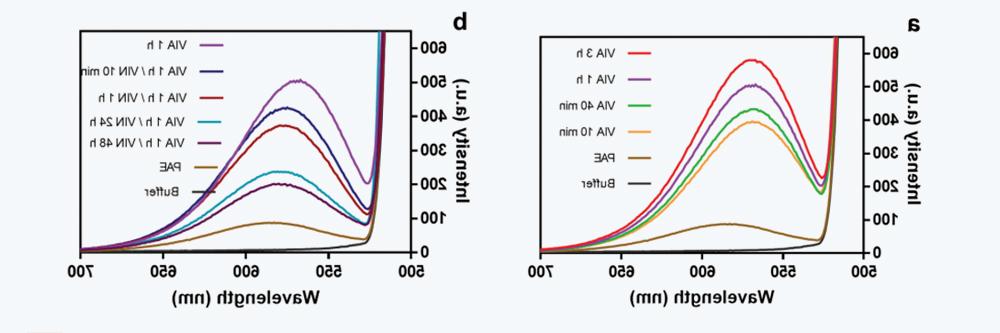
图3 IgG4-N1在不同放置时间下的VIA和VIN样品的荧光强度。(a) at pH 3.3下放置不同时间(10分钟-3小时)的VIA样品(b)VIAAt pH 3.3 Place VIN sample at pH 5 for 1 hour.5 Different time (0-48 hours)。
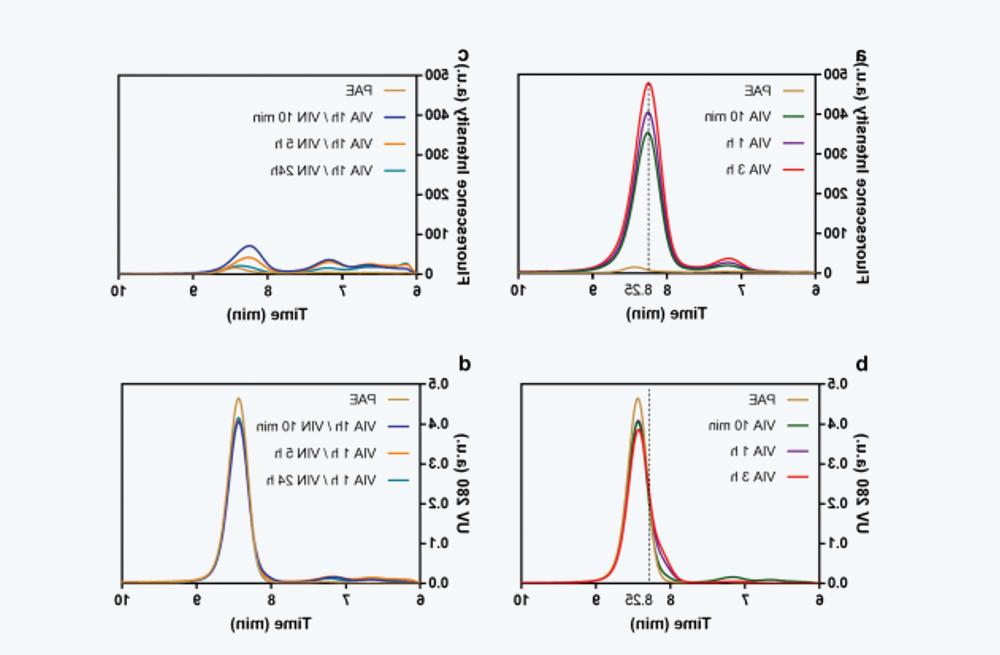
图4 不同放置时间的VIA和VIN样品的在线荧光SEC数据。(a) at pH 3.3下不同放置时间(10分钟-3小时)的VIA样品在线荧光扫描结果。The vertical dashed line corresponds to 8.25 minutes of placement time。(b) UV 280 nm signal superposition of the same sample in a。(c) VIN sample at pH 5.5下不同放置时间(10分钟24小时)的荧光扫描( VIA sample at pH 3.3 Leave for 1 hour)。(d) UV 280 nm signal superposition of the same sample in c。
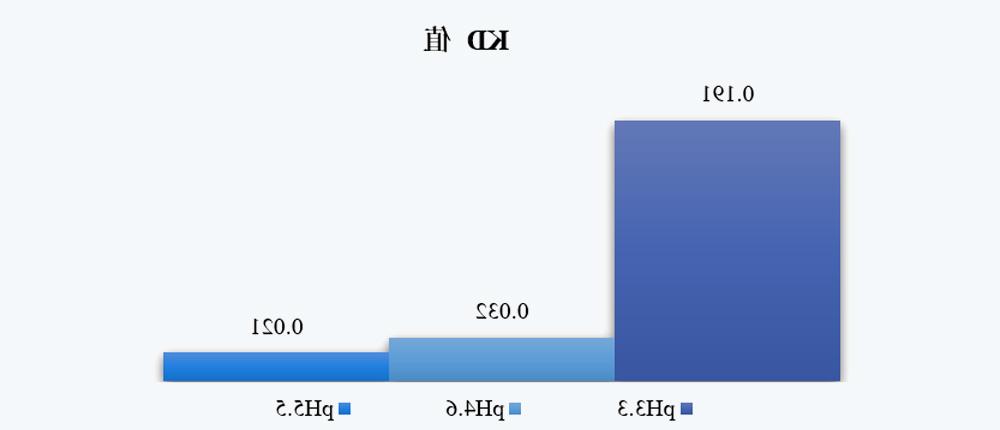
FIG. 5 KD values of VIA samples under different pH conditions
3.4 Surface charge
如图5a所示,随着pH的降低,净电荷如预期般增加,而总电荷减少。如前所述,较低pH下的净电荷和总电荷有助于排斥静电相互作用,阻碍单体缔合和相对良好的胶体稳定性。然而,分子内排斥不可避免地影响维持蛋白质天然结构的静电、范德华力和氢键力的平衡,这解释了在较低pH下Conformational stability较低的原因。
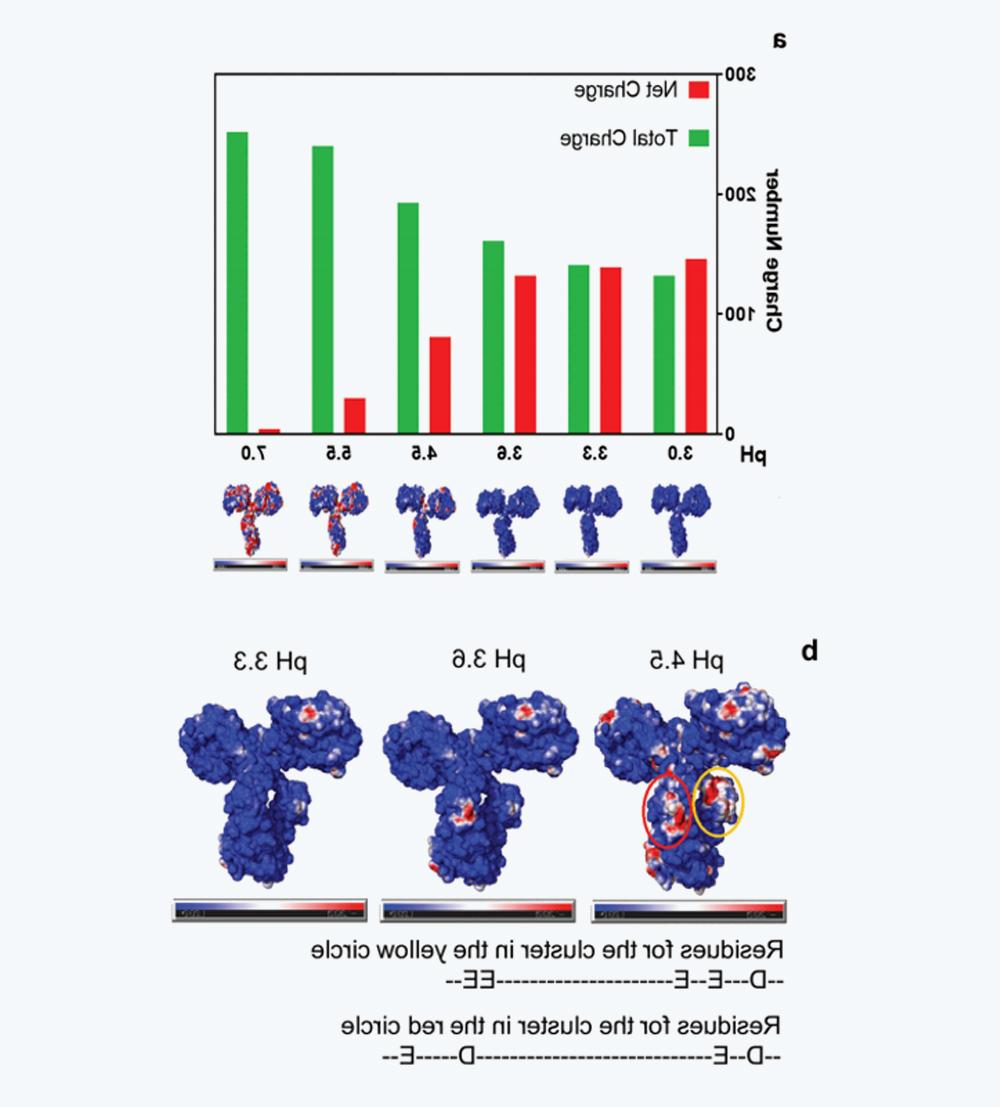
图6 IgG4-N1在不同pH条件下的电荷特性(a)pH 3.0-7.0时的净电荷和总电荷,以及相应的表面电荷分布,其中正电荷、负电荷和中性电荷分别用蓝色、红色和白色表示。(b) pH 4.5、3.6和3.Surface charge distribution at 3, where pH 4.The negatively charged clusters at 5 (CH2) are circled in yellow and red。

3.5Effects of buffer components and excipients on aggregation
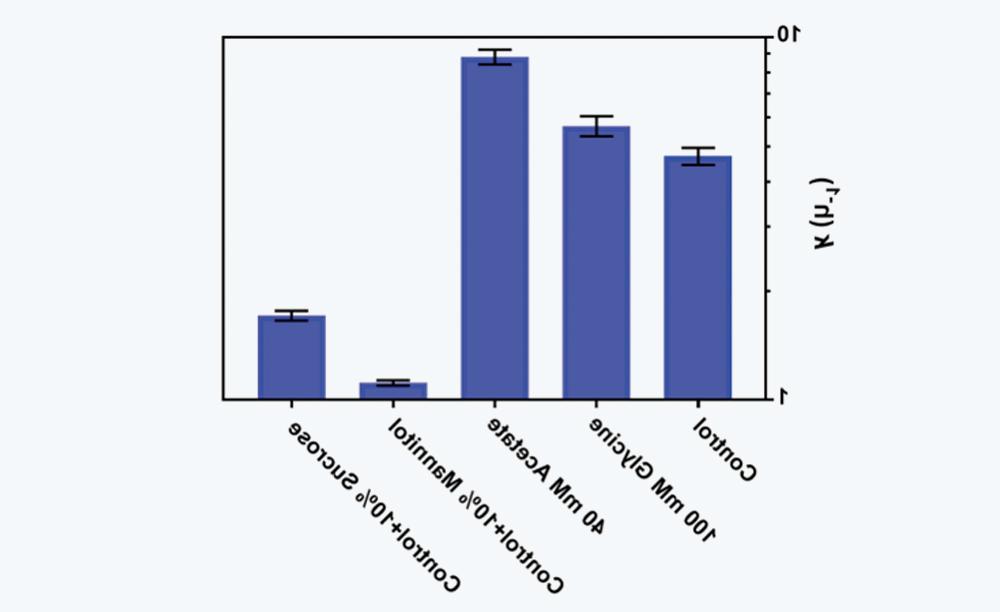
图7 缓冲液组分和赋形剂对酸诱导IgG4-N1聚集速率常数k值的影响。
3.6 CFD modeling to solve scaling challenges for low pH VI operations
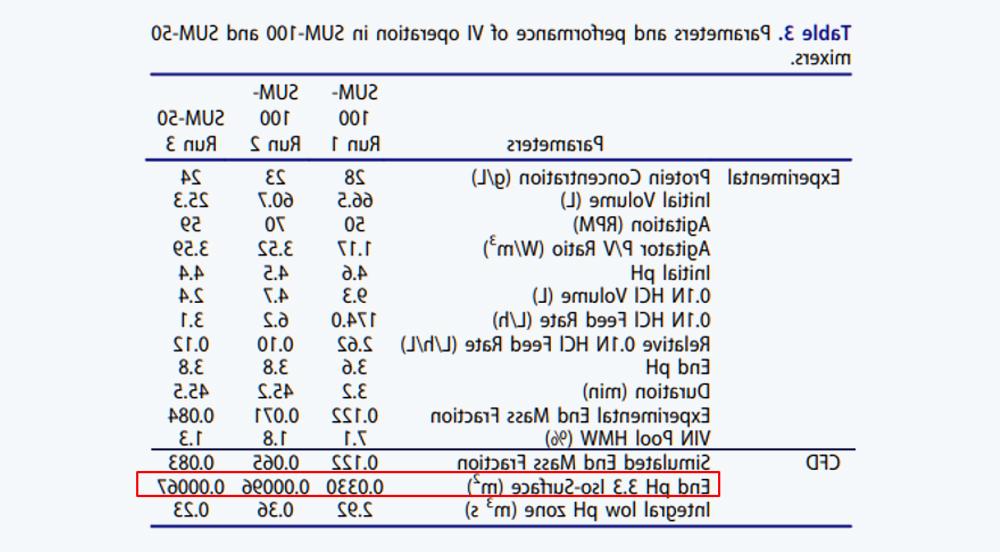
表3 SUM-100和SUM-50两种Mixer中的VI操作参数及表现
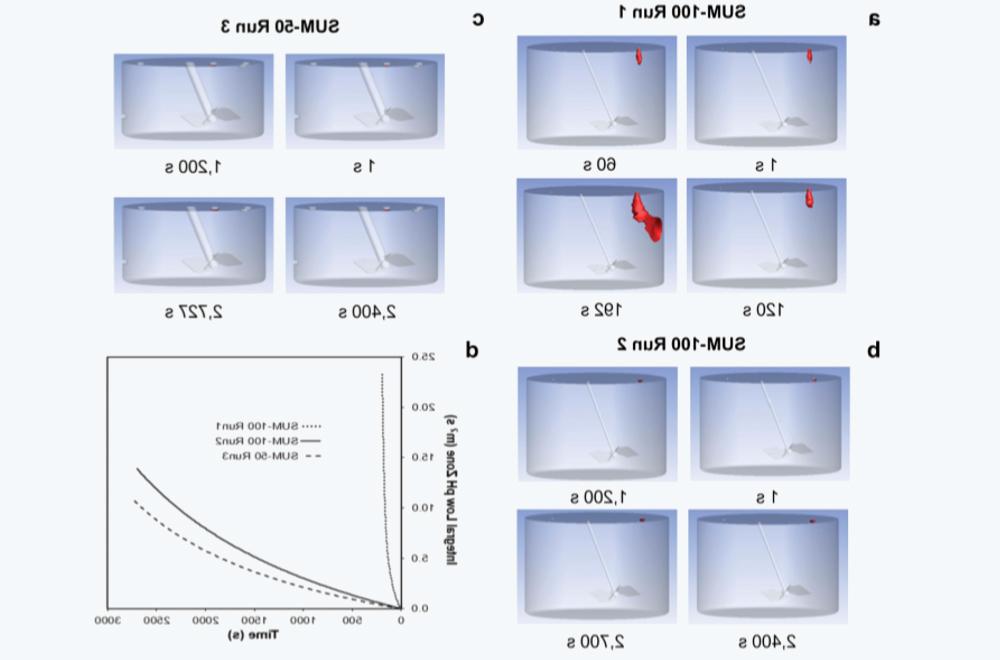
Figure 8 Using CFD to simulate the mixed conditions of SUM operation。(a) The SUM-100 operates under non-optimal mixed conditions1。(b) The SUM-100 operates under optimized mixed conditions2。(c) SUM-50 operates under optimized mixed conditions.3。(d) Integrated low pH zone for three runs (m3 s) as a function of time, in seconds (s)。Local low pH areas in (a), (b), and (c)≤pH 3.3) In red。
4、结论
4.1 IgG4-N1的低pH VIThe influencing factors of forming polymers in the process
混合条件较差会导致VIA过程中形成低pH区,并在VIN过程导致严重的产物聚集。IgG4-N1 tends to accumulate at pH 3.0–3.At 3 than at pH 3.6–8.5 o 'clock is much faster。
At pH 3.3–3.Between 6 and 6, the aggregation rate constant is observed to affect the protein concentration (7.5–30 g/L) weakly dependent at pH 3.0–3.A stronger dependence was observed between 3。
4.2 IgG4-N1的低pH VIDescription of the molecular behavior in the process
在VIA步骤中,低pH条件促进强烈的分子内排斥,导致以表面疏水性增加为特征的部分单体去折叠。这些未折叠的组分比天然单体略大,在SEC色谱图中出现在单体峰的前肩。另一方面,这些单体的强电荷排斥促进了胶体稳定性并防止聚集体形成。
在VIN滴定和放置期间,蛋白质上的排斥电荷在相对中性的pH环境下减少,降低胶体稳定性,并通过分子间相互作用导致了产物聚集。同时,分子内相互作用使得未折叠的单体逐渐变为表面疏水性降低的天然折叠结构。构象改变的单体的复性是与聚集的发生是相互竞争的,这取决于溶液条件和这两个途径之间的相对能量有利性。
4.3 Practical application
IgG4-N1聚集主要归因于酸滴定过程中的非均相混合条件,使用小规模的混合设备时该影响通常是微不足道的,但当使用大规模的系统时需要额外的注意。In addition, improving buffer components or adding excipients can appropriately reduce the aggregation tendency。
Literature source:[1]. Weixin Jin, Zizhuo Xing, Yuanli Song, Chao Huang, Xuankuo Xu, Sanchayita Ghose & Zheng Jian Li (2019) Protein aggregation and mitigation strategy in low pH viral inactivation for monoclonal antibody purification, mAbs, 11:8, 1479-1491, DOI: 10.1080/19420862.2019.1658493







