抗体的糖基化结构对其生物学活性和功能有着重要影响。去除抗体Fc区N-寡糖结构中核心岩藻糖(Fucose)能增强抗体与NK细胞表面激活型受体FcγRIIIa的结合能力,促进NK细胞活化,从而显著提高抗体依赖的细胞毒作用(antibody-dependent cell-mediated cytotoxicity, ADCC)效应,提升抗体的治疗效果。
ADCC与Fucose
无论是在体外和体内,Fc寡糖结构缺乏核心岩藻糖的抗体表现出比岩藻糖基化抗体更有效的功效,去除抗体糖修饰的核心岩藻糖能够显著增强ADCC活性,其机制如图所示,去除核心岩藻糖能够增强抗体与FcγRIIIa的结合能力从而能明显提高ADCC效应,同时去除核心岩藻糖基化的抗体还能够避开血浆IgG(岩藻糖基化的抗体与FcγRIIIa结合强度较低)对ADCC活性的抑制作用。
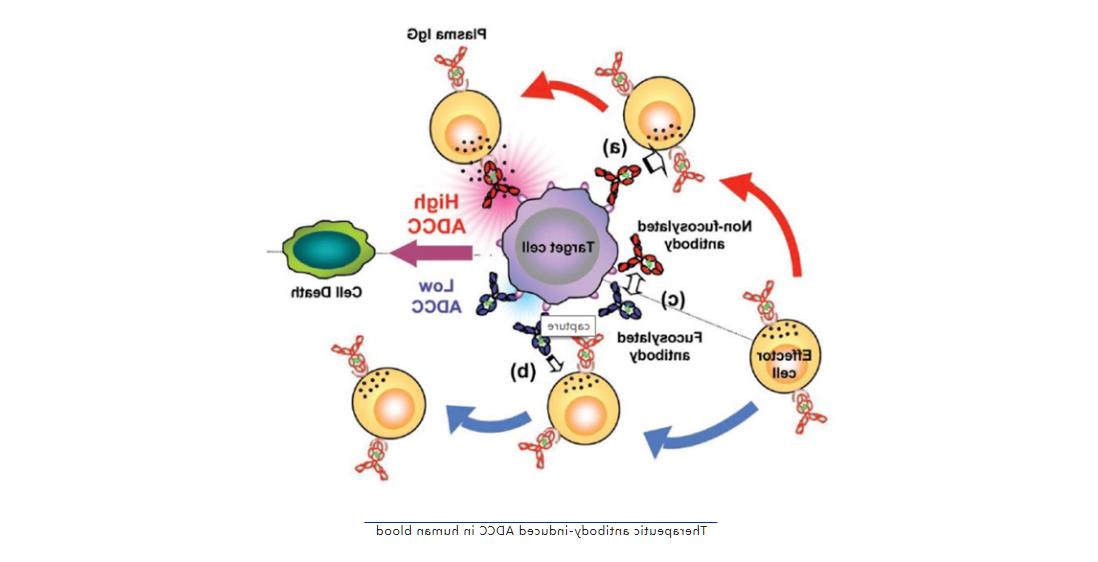
哺乳动物细胞中Fucose合成途径与ADCC增强改造路线
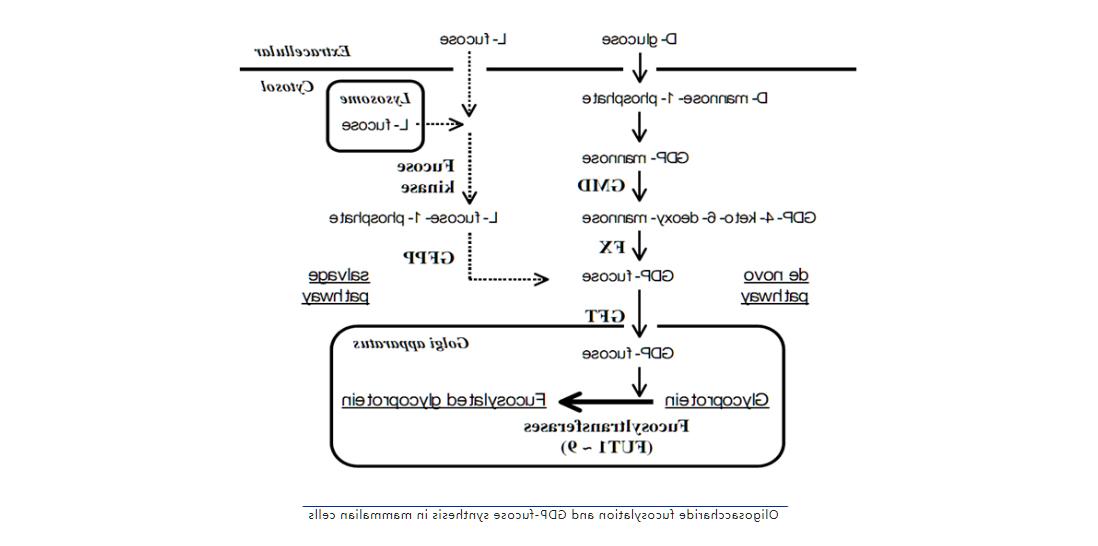
作为治疗性抗体最重要的表达系统,哺乳动物细胞中N-寡糖核心岩藻糖基化所需的活化形式前体GDP-岩藻糖可以经由经典途径及补偿途径两个途径在细胞质内产生,然后由其专一性的GDP-岩藻糖转运蛋白GFT(GDP-fucose-transporter)运输进入细胞高尔基体参与蛋白糖基化合成。如图所示,经典途径通过由两种蛋白质进行的三个酶促反应将GDP-mannose转化为GDP-fucose,而补偿途径从细胞外或溶酶体来源的游离L-岩藻糖合成GDP-fucose。大多数细胞内的GDP-岩藻糖是通过经典途径产生的,无代谢物的L-岩藻糖也通过补偿途径被再利用。积聚在细胞质中的GDP-岩藻糖通过锚定在高尔基体膜上的GDP-岩藻糖转运蛋白(GFT)被转运到高尔基体的管腔中,然后在通过岩藻糖基转移酶合成岩藻糖基化的糖缀合物中充当底物。
根据以上合成途径可以看到,通过表达β-1,4-N-乙酰氨基葡萄糖转移酶III (GnT-III)降低岩藻糖化(如罗氏Gazyva) 、敲除FUT8去岩藻糖化(如日本麒麟Mogamulizumab)、敲除GFT去岩藻糖化(如天广实MIL62、MIL93)、通过RMD共表达降低岩藻糖化(如ProBiogen)均可不同程度进行哺乳动物细胞中Fc寡糖岩藻糖基化的调节。
推荐全球十大博彩公司排行榜的特色ADCC增强技术平台(CHOK1-AF)
推荐全球十大博彩公司排行榜的CHOK1-AF平台,通过基因工程技术改造表达系统,定点敲除抗体表达宿主细胞CHO-K1中岩藻糖修饰途径的关键蛋白GFT,可以有效降低抗体岩藻糖修饰水平。其优势在于该方法可以同时阻断岩藻糖基化经典途径及补偿途径,从而达到完全去除岩藻糖基化的目的(其岩藻糖敲除率高达98%以上)。构建的宿主细胞CHOK1-AF进行cGMP细胞建库,并进行二级GMP细胞库管理。CHOK1-AF MCB、WCB按照中国药典和ICH中细胞基质检定要求进行细胞库检定,其检定结果符合药典对细胞基质的要求。并经过全面的表征研究,包括FACS分析、WGS测序、Karyotype分析及表达抗体的N-Glycans分布研究、细胞株稳定性研究和深入的工程细胞株理化属性研究。
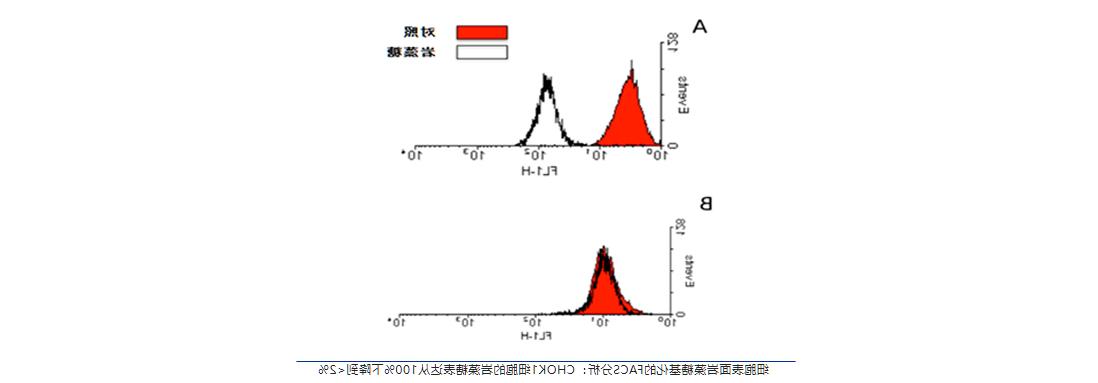
运用该宿主细胞(CHOK1-AF)稳定转染并筛选工程细胞株,其表达抗体的N-Glycans分布正常, 细胞经过>100PDL传代,糖型结构未发生显著变化,同时表达抗体理化属性正常且稳定性良好,与Fc区氨基酸定点改造技术路径相比具有优势。同时其生产工艺稳健、不同生产规模批间高度一致、CMC开发成本低。

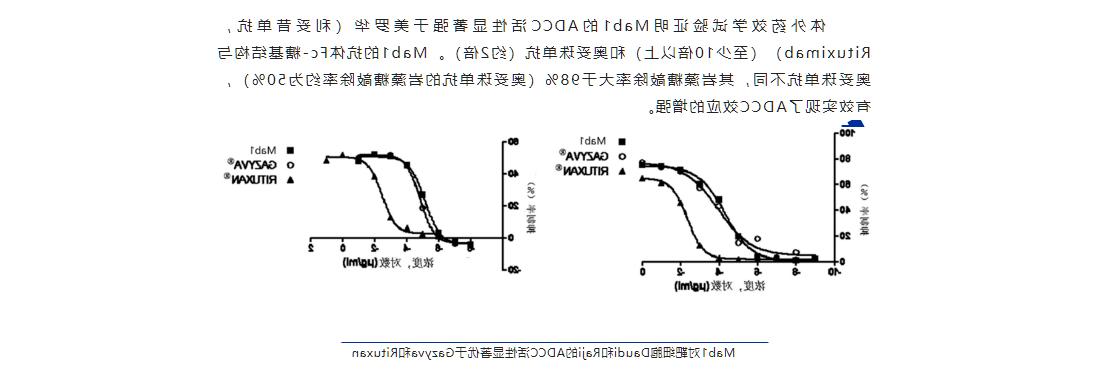
体外药效学试验证明Mab1的ADCC活性显著强于美罗华(利妥昔单抗,Rituximab)(至少10倍以上)和奥妥珠单抗(约2倍)。Mab1的抗体Fc-糖基结构与奥妥珠单抗不同,其岩藻糖敲除率大于98%(奥妥珠单抗的岩藻糖敲除率约为50%),有效实现了ADCC效应的增强。
临床前研究显示Mab1的体内药效也比美罗华、奥妥珠单抗更优,Mab1能够显著抑制CD20+B细胞淋巴瘤Daudi裸鼠皮下移植瘤的生长,引起肿瘤消退,而且其抑瘤率与奥妥珠单抗相当、明显优于美罗华。Mab1体现出经典的II型抗体的特点,具有更强的细胞死亡诱导效应和更强的ADCC效果。与岩藻糖敲除效率成正相关,其余FcγRIIIa的亲和力远远高于同类产品。
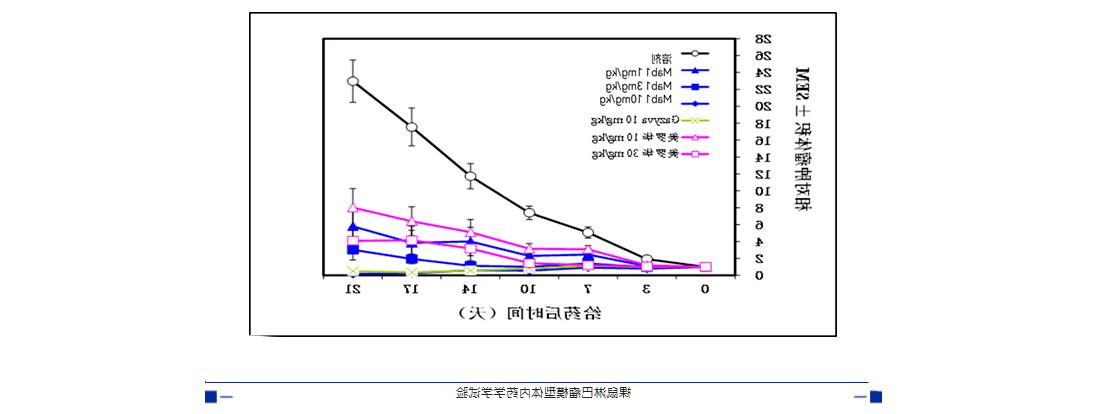
该宿主细胞应用于十余个Pre-Clinical和Clinical阶段项目,包括临床I期、II期和关键临床III期。临床前和临床数据均显示其表达的ADCC增强型抗体靶向杀伤肿瘤细胞的有效性和安全性。多个项目在临床试验中均显示出良好的安全性和耐受性,同时在实体瘤患者中具有良好的治疗反应。
平台简介
— 采用GFT敲除去岩藻糖化增强抗体ADCC效应的技术平台
— 岩藻糖敲除率大于98%
— 宿主细胞CHO-K1 来源于ATCC、ECACC
— CHOK1-AF 在符合GMP规范的条件下建库、检定
— 除去岩藻糖化工程改造细胞株生长特性和抗体表达符合大规模生产的要求
— 临床前和临床数据显示ADCC增强型抗体靶向杀伤肿瘤细胞的有效性和安全性
参考文献:
Martensson A. Development of an Antigen-independent Affinity Assay to Study the Binding of IgG to Fc Gamma Receptors. Chemistry. 2012. Naoko Yamane-Ohnuki MS. Production of therapeutic antibodies with controlled fucosylation. mAbs. 2009. Harue Imai-Nishiya. Double knockdown of α1,6-fucosyltransferase (FUT8) and GDP-mannose 4,6-dehydratase (GMD) in antibody-producing cells: a new strategy for generating fully non-fucosylated therapeutic antibodies with enhanced ADCC. BMC Biotechnology. 2007. Naoko Yamane-Ohnuki. Establishment of FUT8 Knockout Chinese Hamster Ovary Cells: An ldeal Host Cell Line for Producing Completely Defucosylated Antibodies With Enhanced Antibody-Dependent Cellular Cytotoxicity. Biotechnol Bioeng. 2004. METHODS OF RECOMBINANT PROTEIN EXPRESSION IN A CELL COMPRISING REDUCED UDPGALACTOSE TRANSPORTER ACTIVITY. WO2016068799A1. ANTI-CD20 ANTIBODY. WO2018041067A1.






